




胶原(collagen)
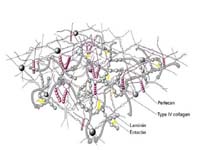
胶原是动物体内含量最丰富的蛋白质,约占人体蛋白质总量的30%以上。它遍布于体内各种器官和组织,是细胞外基质中的框架结构,可由成纤维细胞、软骨细胞、成骨细胞及某些上皮细胞合成并分泌到细胞外。
目前已发现的胶原至少有19种,由不同的结构基因编码,具有不同的化学结构及免疫学特性。Ⅰ、Ⅱ、Ⅲ、Ⅴ及Ⅺ型胶原为有横纹的纤维形胶原。
各型胶原都是由三条相同或不同的肽链形成三股螺旋,含有三种结构:螺旋区,非螺旋区及球形结构域。其中Ⅰ型胶原的结构最为典型。
Ⅰ型胶原的原纤维平行排列成较粗大的束,成为光镜下可见的胶原纤维,抗张强度超过钢筋。其三股螺旋由二条α1(Ⅰ)链及一条α2(Ⅰ)链构成。每条α链约含1050个氨基酸残基,由重复的Gly-X-Y序列构成。X常为Pro(脯氨酸),Y常为羟脯氨酸或羟赖氨酸残基。重复的Gly-X-Y序列使α链卷曲为左手螺旋,每圈含3个氨基酸残基。三股这样的螺旋再相互盘绕成右手超螺旋,即原胶原。
原胶原分子间通过侧向共价交联,相互呈阶梯式有序排列聚合成直径50~200nm、长150nm至数微米的原纤维,在电镜下可见间隔67nm的横纹。胶原原纤维中的交联键是由侧向相邻的赖氨酸或羟赖氨酸残基氧化后所产生的两个醛基间进行缩合而形成的。原胶原共价交联后成为具有抗张强度的不溶性胶原。胚胎及新生儿的胶原因缺乏分子间的交联而易于抽提。随年龄增长,交联日益增多,皮肤、血管及各种组织变得僵硬,成为老化的一个重要特征。
人α1(Ⅰ)链的基因含51个外显子,因而基因转录后的拼接十分复杂。翻译出的肽链称为前α链,其两端各具有一段不含Gly-X-Y序列的前肽。三条前α链的C端前肽借二硫键形成链间交联,使三条前α链“对齐”排列。然后从C端向N端形成三股螺旋结构。前肽部分则呈非螺旋卷曲。带有前肽的三股螺旋胶原分子称为前胶原(procollagen)。胶原变性后不能自然复性重新形成三股螺旋结构,原因是成熟胶原分子的肽链不含前肽,故而不能再进行“对齐”排列。
前α链在粗面内质网上合成,并在形成三股螺旋之前于脯氨酸及赖氨酸残基上进行羟基化修饰,脯氨酸残基的羟化反应是在与膜结合的脯氨酰-4羟化酶及脯氨酰-3羟化酶的催化下进行的。维生素C是这两种酶所必需的辅助因子。维生素C缺乏导致胶原的羟化反应不能充分进行,不能形成正常的胶原原纤维,结果非羟化的前α链在细胞内被降解。因而,膳食中缺乏维生素C可导致血管、肌腱、皮肤变脆,易出血,称为坏血病。
胶原(collagen)是细胞外基质的最重要成分,目前已发现至少19型胶原,但肝脏中含量较高者仅包括Ⅰ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅹ和Ⅷ型。正常人肝脏的胶原含量约为5mg/g肝湿重,Ⅰ/Ⅲ型胶的比为1:1,各占33%左右;肝纤维化和肝硬化时肝脏胶原含量可增加数倍,且Ⅰ/Ⅲ型的比值可增加到3:1左右。
根据胶原的结构和功能可将其分为7类:
1.纤维性胶原(fibril forming collagen) 这是最经典的胶原,如Ⅰ、Ⅲ、Ⅴ和Ⅺ型胶原。其肽链长达1000个氨基酸,是结缔组织中含量最丰富的胶原。前胶原三螺旋的端肽被切除后纵向平行排列,其中每个胶原分子纵向稍偏移,相邻的肽链形成共价键交联从而形成微纤维。一般需经前胶原肽酶(procollagen propeptidase)将羧基端肽去除后才能形成胶原纤维,但是部分胶原可以带有氨基端肽而存在于胶原纤维的表面,以阻止胶原纤维继续增粗,从而继续起到调节胶原纤维直径的作用。
2.网状胶原(network forming collagen) 如Ⅳ、Ⅷ和Ⅹ型胶原,主要分布于基底膜中。与纤维性胶原不同,其端肽不被去除。两条Ⅳ型前胶原肽链的羧基端肽(NC1)端-端相连形成二聚体,四条前胶原肽链的氨基端肽(7S)端-端形成四聚体,从而相互交联成三维网状结构。在肝脏中,Ⅳ型胶原主要分布于血管和胆管的基底层,而且还分布于汇管区的成纤维细胞周围及正常肝血窦的Disse腔中。Ⅷ型胶原常与弹性纤维一起分布于肝脏的汇管区和包膜中,其功能尚不清楚。
3.微丝状胶原(microfilament forming collagen) 目前此组只包括ⅥM型胶原。其肤链较短,仅为纤维性胶原的三分之一左右。两条肤链反向平行排列,借端肤相互交联成二聚体,二聚体冉端-端相连聚集成四聚体。许多四聚体端-端相接形成状如串珠的微丝状长链。在肝脏中Ⅳ型胶原分布于汇管区基质和肝血卖Disse腔隙。Ⅵ型胶原通常分布在Ⅰ型和Ⅲ型胶原纤维之间,推测其功能是将血管结构锚定到间质中。最近发现Ⅵ型胶原对多种上皮细胞和间质细胞包括肝脏星状细胞的生长有促进作用,并可抑制细胞凋亡。
4.锚丝状胶原(collagen of aachoring filament)Ⅶ型胶原属此组,其肽链三螺旋长达1530个氨基酸,中间穿插许多非胶原序列。两条前胶原肽链的羧基端肽端-端重叠交联形成二聚体,多个二聚体以羧基端交联区为中心侧-侧聚集成锚丝状纤维。这一纤维的两个氨基端肽连接到基地膜的某种分子上起锚定作用,故名。
5.三螺旋区不连续的纤维相关性胶原(fibril associated collagens with intenrupted triplehelices;FACIT)这一组包括Ⅸ、Ⅻ、ⅩⅣ、ⅩⅥ及ⅩⅨ型胶原,而且其数目还不断增加。其本身不形成纤维,但与纤维性胶原纤维的表面相连。目前对这一组胶原的确切功能及组织、细胞分布尚不了解。ⅩⅣ型曾被称为粗纤维调节素(undulin),但现在认为其特征性结构为胶原三螺旋,故名ⅩⅣ型胶原。
6.跨膜性胶原(transmembrane collagen) 如ⅩⅦ型胶原,它有一个细胞内非胶原区,一个跨膜区和细胞外胶原尾巴。这种胶原主要由皮肤基底角化细胞产生,在肝脏中未发现。
7.尚未分类的胶原:包括ⅩⅢ,ⅩⅤ和ⅩⅧ型胶原。ⅩⅢ型胶原主要分布于皮肤附属器、骨、软骨、横纹肌及肠道黏膜,但不见于肝脏。ⅩⅤ型胶原mRNA表达于许多组织和器官的成纤维细胞和上皮细胞。ⅩⅧ型胶原主要分布于肝脏、肺脏和肾脏。值得一提的是,原位杂交研究结果表明在肝脏中ⅩⅧ型胶原主要由肝实质细胞产生,显然与其它胶原主要由间质细胞产生不同。其羧基端具有抑制血管增生的作用而称为内皮抑素或内皮它汀(endostatin),初步体外和动物试验发现它对肿瘤有较强的抑制作用。
京ICP备15036693号-2  京公网安备11010802025653 版权所有:北京逸优科技有限公司
京公网安备11010802025653 版权所有:北京逸优科技有限公司